Related Articles
- 01 Ott 13
 Mentre una gravidanza è una bella notizia, soprattutto per le coppie che hanno affrontato sfide della fertilità, è solo l'inizio di un cammino. Purtroppo non tutte le gravidanze sono 40 settimane di gestazione tranquilla. Alcune donne si trovano ad affrontare problemi più gravi, come il sanguinamento vaginale (e i conseguenza presunti una minacce d'aborto) dando origine a molto stress ed ansia, mentre altri soffrono di nausea e vomito
Mentre una gravidanza è una bella notizia, soprattutto per le coppie che hanno affrontato sfide della fertilità, è solo l'inizio di un cammino. Purtroppo non tutte le gravidanze sono 40 settimane di gestazione tranquilla. Alcune donne si trovano ad affrontare problemi più gravi, come il sanguinamento vaginale (e i conseguenza presunti una minacce d'aborto) dando origine a molto stress ed ansia, mentre altri soffrono di nausea e vomito - 26 Ago 13
 I problemi mestruali, sono preoccupazioni comuni nella salute della donna, in particolare la sindrome premestruale (SPM), le mestruazioni dolorose (dismenorrea), e l’irregolarità o l’assenza del ciclo mestruale (amenorrea). Questi sintomi possono procurare, per il protrarsi di alcune condizioni mediche la sindrome dell'ovaio policistico (PCOS), l’endometriosi e dei fibromi uterini. Sebbene non sono mortali, questi problemi hanno ripercussioni negative sulla qualità della vita della donna ed sono un segnale di problemi irrisolti.
I problemi mestruali, sono preoccupazioni comuni nella salute della donna, in particolare la sindrome premestruale (SPM), le mestruazioni dolorose (dismenorrea), e l’irregolarità o l’assenza del ciclo mestruale (amenorrea). Questi sintomi possono procurare, per il protrarsi di alcune condizioni mediche la sindrome dell'ovaio policistico (PCOS), l’endometriosi e dei fibromi uterini. Sebbene non sono mortali, questi problemi hanno ripercussioni negative sulla qualità della vita della donna ed sono un segnale di problemi irrisolti. - 26 Ago 13
 Un area emergente di studio, si dedica allo studio dell'impatto di alcuni fattori nei primi anni di vita includendo l’impatto dell’alimentazione sullo sviluppo delle malattie in seguito nella vita. Il fetal origins of adult disease (FOAD-SPIRIT) è un campo il cui obbiettivo è quello di studiare il legame tra condizioni materno/ fetale durante vita prenatale, e il rischio di malattia cronica nell'età adulta. Anche se questo potrebbe sembrare scontato, l'estensione della sua influenza non fu realizzato fino a poco tempo fa.
Un area emergente di studio, si dedica allo studio dell'impatto di alcuni fattori nei primi anni di vita includendo l’impatto dell’alimentazione sullo sviluppo delle malattie in seguito nella vita. Il fetal origins of adult disease (FOAD-SPIRIT) è un campo il cui obbiettivo è quello di studiare il legame tra condizioni materno/ fetale durante vita prenatale, e il rischio di malattia cronica nell'età adulta. Anche se questo potrebbe sembrare scontato, l'estensione della sua influenza non fu realizzato fino a poco tempo fa. - 20 Dic 16
 L’anello e il cerotto sono due varianti della pillola anticoncezionale per via orale e quindi hanno lo stesso rischio, medesimi effetti collaterali e controindicazioni della “pillola”. Prodotti come Nuvaring ed Evrapatch rilasciano ormoni femminili (sia estrogeni che progestina) per tre settimane per bloccare l’ovulazione e prevenire una gravidanza.
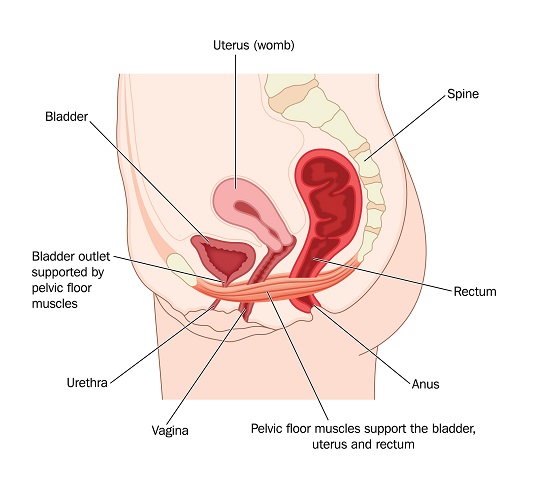
L’anello e il cerotto sono due varianti della pillola anticoncezionale per via orale e quindi hanno lo stesso rischio, medesimi effetti collaterali e controindicazioni della “pillola”. Prodotti come Nuvaring ed Evrapatch rilasciano ormoni femminili (sia estrogeni che progestina) per tre settimane per bloccare l’ovulazione e prevenire una gravidanza. - 05 Mag 19La struttura del pavimento pelvico crea un sistema di supporto per gli organi pelvici. Questi muscoli, composti dal diaframma pelvico e dal complesso elevatore dell'ano, formano un'imbracatura intorno all'uretra, alla vagina distale e al retto. Senza questo supporto strutturale, le donne sono a rischio di sviluppare disturbi del pavimento pelvico, come prolasso degli organi pelvici, sindrome vescicale iperattiva, incontinenza urinaria da stress e incontinenza fecale. I danni o l'indebolimento di questi muscoli possono verificarsi a causa di parto, invecchiamento, balzi o salti ripetitivi e dal precedente "non utilizzo" o non rafforzamento dei muscoli del pavimento pelvico.
- 31 Ott 18Il tuo ciclo è in ritardo, ma davvero in ritardo. Non sei incinta e non sei in menopausa.
- 30 Set 18L'endometriosi è uno stato cronico di dolore e nel 2009 si stimava che 344.000 donne in Canada fossero colpite da tale condizione.[1]
- 31 Mar 19Lo squilibrio ormonale è un problema comune che molte donne affrontano. Le donne, ora più che mai, assumono sempre più responsabilità: sono tutrici, educatrici e impiegate nella forza lavoro per far quadrare le cose.
- 04 Mag 19In gravidanza, ci sono tre trimestri, che si estendono su nove mesi. Il post-partum, è a volte indicato come il "quarto trimestre" e può essere suddiviso in tre fasi distinte.
- 30 Set 18Quando si parla della salute della cervice delle donne, il pap test, noto anche come striscio vaginale, è notevolmente importante nel ridurre l'incidenza del cancro alla cervice.[1]
- 31 Ago 18La maggior parte delle donne passa tutta la vita aspettando la conclusione del ciclo mestruale. "Basta con il disagio!"
- 31 Ott 18La sindrome dell'ovaio policistico (PCOS) è una condizione rappresentata da entrambi i sintomi riproduttivi ed endocrini.
- 30 Nov 18La fluttuazione degli ormoni sessuali durante il ciclo mestruale può portare a cambiamenti in diversi ambiti, quali energia, umore o sintomi fisici, più comunemente nella tarda fase luteale. Anche se i sintomi possono comparire all'inizio del periodo ovulatorio e proseguire fino alla comparsa del ciclo mestruale, come è comune nel disordine premestruale disforico (PMDD), si presenta un grave disturbo distinto, riconosciuto nel DSM 5 per i suoi intensi sintomi di natura cognitiva.[1]
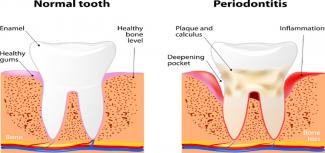
- 31 Mag 18Certo, la pulizia dentale è ottima per la nostra salute orale, ma sapevi che può anche migliorare il benessere di tutto il corpo?
- 05 Gen 16La Sindrome dell’ovaio policistico (PCOS) è la causa più frequente di infertilità anovulatoria pari al 5-10% delle donne in età fertile. L’Anovulazione è l’anormale funzione ovarica che impedisce alle ovaie il rilascio di ovocita (uova) durante il ciclo mestruale (1, 2). In PCOS, è stata rilevata mediante l’utilizzo di ultrasuoni una frequente formazione di cisti ovariche e di un chiaro squilibrio ormonale conseguenzialmente confermato da risultati biochimici. In una patologia di PCOS si evidenzia una quantità eccessiva di androgeni (gli ormoni sessuali maschili) risultante da livelli elevati di testosterone (2). L'eccesso di testosterone manifesta chiaramente alcuni dei segni e sintomi della PCOS come l’irsutismo con una presenza eccessiva di peluria sul viso e sul corpo, acne e diradamento o caduta dei capelli. (2,3).
- 31 Gen 18La differenza principale tra il baby blues e la depressione post-parto risiede nella gravità e nella durata dei sintomi.
- 03 Mar 14
 Il numero di coppie che ha problemi di infertilità e/o ricorre alle tecnologie di riproduzione assistita (PMA, chiamate anche ART, dall'inglese Assisted Reproductive Technology) è in aumento (1). Uno studio pubblicato nel 2012 ha rilevato che tra le coppie canadesi (con donne tra i 18 e i 40) la prevalenza di infertilità variava tra l'11% e il 15%, il che rappresentava un aumento rispetto alle statistiche precedenti
Il numero di coppie che ha problemi di infertilità e/o ricorre alle tecnologie di riproduzione assistita (PMA, chiamate anche ART, dall'inglese Assisted Reproductive Technology) è in aumento (1). Uno studio pubblicato nel 2012 ha rilevato che tra le coppie canadesi (con donne tra i 18 e i 40) la prevalenza di infertilità variava tra l'11% e il 15%, il che rappresentava un aumento rispetto alle statistiche precedenti - 23 Dic 16
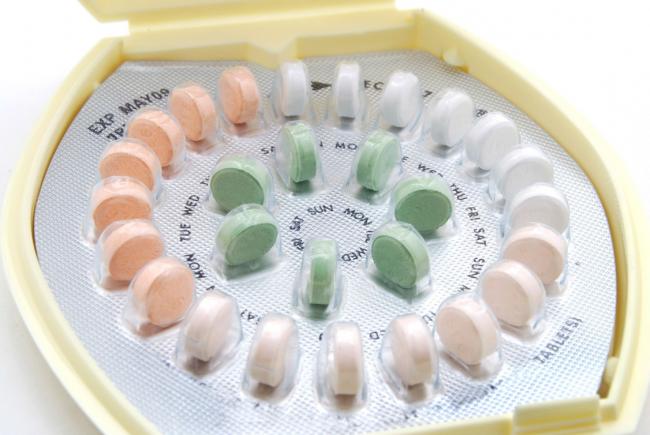
 Il composto della pillola anticoncezionale ad assunzione orale è generalmente una combinazione di estrogeni e progestina da assumersi oralmente per prevenire la fertilità femminile e la gravidanza. È stata introdotta per la prima volta nel 1960 e da allora ha subito molte modifiche ed è stata usata da milioni di donne in tutto il mondo. Delle donne canadesi che utilizzano metodi contraccettivi, il 32% usa la pillola come metodo di contraccezione
Il composto della pillola anticoncezionale ad assunzione orale è generalmente una combinazione di estrogeni e progestina da assumersi oralmente per prevenire la fertilità femminile e la gravidanza. È stata introdotta per la prima volta nel 1960 e da allora ha subito molte modifiche ed è stata usata da milioni di donne in tutto il mondo. Delle donne canadesi che utilizzano metodi contraccettivi, il 32% usa la pillola come metodo di contraccezione - 30 Apr 17La fertilità risente dei relativi processi di invecchiamento biologico femminile e rappresenta una sempre crescente preoccupazione per coloro che desiderano concepire. È comunemente noto che la qualità e quantità dell’ovulo femminile subisce un calo con l’avanzare dell’età; ed è inoltre importante essere consapevoli del fatto che questo declino legato all’età avviene indipendentemente dai continui cicli ovulatori e/o dalle mestruazioni [1].
- 31 Ago 14Il termine dismenorrea viene comunemente utilizzato per descrivere mestruazioni dolorose. Un trattamento efficace per la dismenorrea, considerata come una delle più comuni condizioni della salute femminile, si basa sulla determinazione e sulla risoluzione della causa alla radice.
Newsletter
Le informazioni fornite non sono valide. Controlla il formato del campo e riprova.
La tua iscrizione è andata a buon fine.
Più Popolare
- 17 Giu 13
- 17 Giu 13
- 17 Giu 13
- 01 Lug 13
- 17 Giu 13
- 17 Giu 13
- 17 Giu 13
- 01 Lug 13
- 17 Giu 13
- 17 Giu 13
- 17 Giu 13
- 01 Lug 13